“结构”解锁蛋白质科学新领域:北大团队提出拓扑改造新方法,助力迈向高分子化学“圣杯”
今天,很高兴为大家分享来自DeepTech深科技的解锁蛋白质科学新领域:北大团队提出拓扑改造新方法,助力迈向高分子化学“圣杯”,如果您对解锁蛋白质科学新领域:北大团队提出拓扑改造新方法,助力迈向高分子化学“圣杯”感兴趣,请往下看。
来源:DeepTech深科技
“本次工作解锁了蛋白质科学的新领域,从化学意义上大大打开了蛋白质拓扑结构的边界。”北京大学教授张文彬表示。

日前,他和团队打造出一款具有一定普适性的蛋白质拓扑改造方法,可以在不改变蛋白质三维结构和功能的前提下,对其化学拓扑结构进行改造,从而提升其稳定性。这提示着对于大自然中的线型蛋白质来说,都可能存在着与其类似的拓扑版本的“孪生兄弟”,发展出全新的蛋白质品类。若干年内,该方法将有望被用于生物催化、大分子药物甚至医美材料等领域。
 (来源:Nature Communications)
(来源:Nature Communications) 助力迈向高分子化学的“圣杯”
助力迈向高分子化学的“圣杯”张文彬表示:“我是高分子化学出身。高分子化学的‘圣杯’在于控制高分子链结构的长度、序列、立体化学和拓扑结构。蛋白质的细胞合成可以完美控制前三者,而拓扑结构的合成一直到最近才取得了可喜的进展。”

积极拥抱人工智能
该工作在研究期间也充满了各种挑战性,前后持续将近 5 年。第一阶段主要是选定研究对象以及确定工程化策略。期间,该团队选择了荧光蛋白,不仅是因为其性质更容易被表征,还因为它对于蛋白质工程化改造存在较好的耐受性。
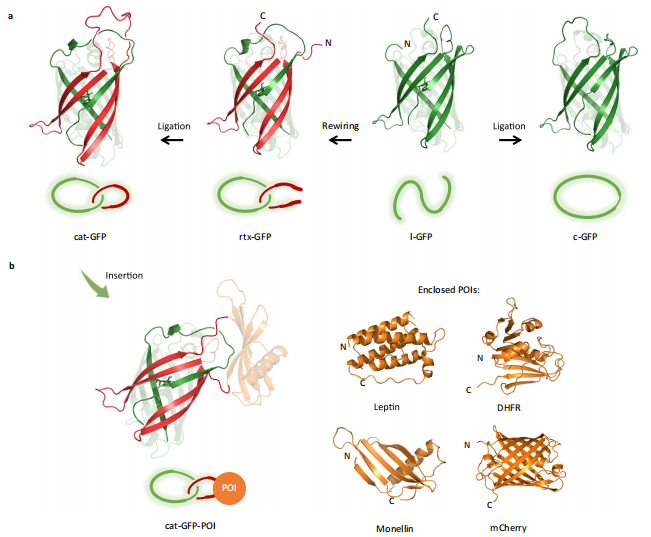
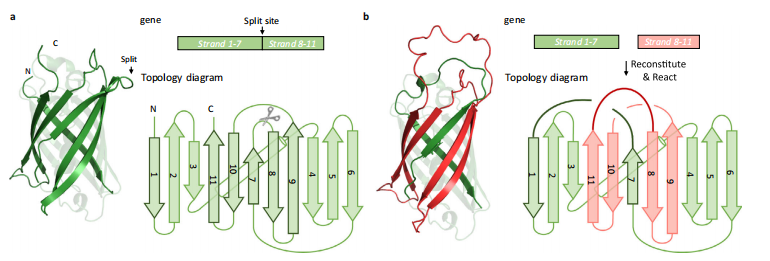
拆分和重新接线,会给蛋白质改造带来重大影响。通过对 GFP 晶体结构的观察,课题组设计了多种潜在的拆分方法和重新接线的方法,并对它们逐一验证和优化,对各种可能影响合成效率的细节进行微调,包括如何保证空间缠结结构的形成、如何选取速率合适的关环工具、如何找到合适的关环位点等。
在优化构建条件和合成条件之后,他们又聚焦于拓扑的构效关系,通过构建索烃蛋白的环状对照和线型对照,详细研究它们之间的性质差异。
结果发现:索烃结构确实可以大幅提升蛋白质的热恢复性。这和他们的预期保持一致。其中,单结构域蛋白质索烃所展现的拓扑效应是最显著的。他们很快意识到,这种拓扑限制效应也许可以被拓展到其他的功能蛋白。
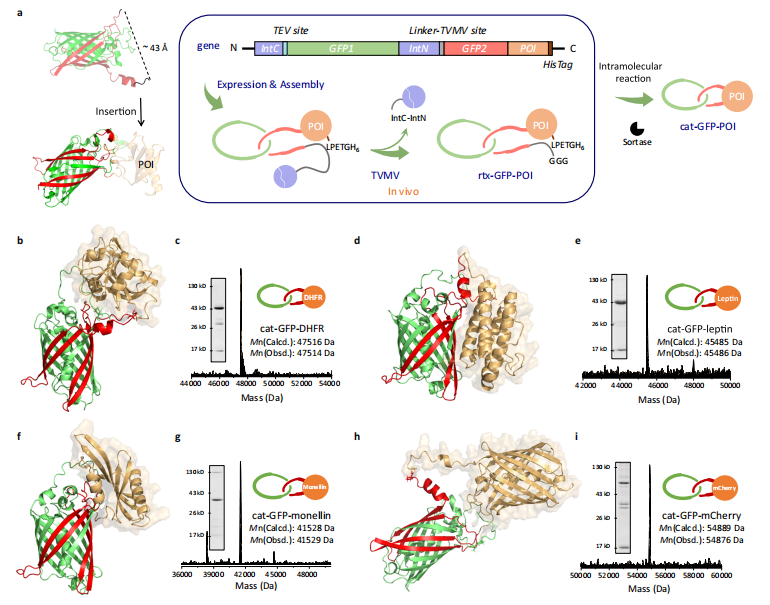
为此,他们将单结构域荧光蛋白索烃作为缠结骨架,借此构建出多种融合蛋白索烃。通过系统研究后,他们发现这种索烃化的方法,基本不会影响插入的功能蛋白结构和活性,故在一定程度上可以提升功能蛋白的热稳定性、热恢复性以及机械稳定性。
在早期研究中,他们碰到了很多困难,其中包括缺乏合适的方式来实现设计的可视化,评估设计的合理性等等。那时他们常常需要在电脑前盯着天然绿色荧光蛋白的结构,在脑海中凭空构思可能的拆分结构和重连结构,甚至还尝试用铁丝弯曲模拟出蛋白的折叠结构,借此揣测拓扑蛋白形成的合理性,并估算究竟需要多长的连接链和怎样的序列才能控制链的柔性和走向。
就在这样的条件下,他们仍然成功设计并合成了绿色荧光蛋白的单结构域索烃,这让大家感到非常自豪,同时它也坚定了课题组使用计算机技术和人工智能来赋能拓扑设计的决心,从而为本次研究的未来发展指明了方向。
除去设计之外,合成和纯化也是巨大的挑战。例如,胞内合成很难控制组装和反应发生的时序性,以至于会产生大量的单环组装体,而这些单环组装体在生理条件之下可以稳固组装在一起,使得索烃结构的纯化极其困难。
那段时间大家集思广益,也尝试了许多别出心裁的方法:包括采用非变性丙烯酰胺蛋白胶尝试切胶纯化、在蛋白质样品中加入大量乙醇试图破坏单环组装体之间的相互作用、将蛋白质萃取到有机试剂中等。直到最后,他们利用索烃蛋白的稳定性,通过高温孵育结合透析,实现了单结构域荧光蛋白索烃的高选择性纯化。
张文彬表示:“这个过程促进了我们对于合成工具和方法的深入思考。我们不仅要选择可以相互协同匹配的缠结和反应基元,还需要尽量通过设计让单环片段变得不太稳定,从而使合成具备更高的选择性,简化后续的纯化步骤。”
他继续说道:“这些事情其实也是科研过程的常态,如切如磋,如琢如磨,只有在失败中学习,才能不断打破已知和未知的边界。”
 (来源:Nature Communications)
(来源:Nature Communications)未来,他们打算将本次改造方法继续拓展到更多蛋白质结构之中,不仅包括其他的荧光蛋白,还包括生物酶、生长因子、结构蛋白、抗体等各种结构。课题组有志于实现更多高质量拓扑蛋白质的合成与进化,真正让蛋白质结构可以在不同拓扑结构的“平行宇宙”之间自由穿梭,从而拓展出更多的实际应用。
 (来源:Nature Communications)
(来源:Nature Communications)另据悉,张文彬博士毕业于美国阿克伦大学高分子科学系,师从该校的程正迪教授。后来,张文彬的第一站博士后也是在这里完成。
如今,尽管张文彬已经回国加入北大,但是他的个人主页依然可以链接到程正迪教授的课题组主页。他表示:“程先生对我影响很大。他不仅是我的博士导师,更是我的人生导师。跟随程先生求学的六年,是我人生中收获最大、改变最多的六年。他是我眼中大先生的典范。我虽不及先生万一,但也愿意追随先生脚步,做一束光。”
 参考资料:
参考资料:1.Qu, Z., Fang, J., Wang, YX. et al. A single-domain green fluorescent protein catenane. Nat Commun 14, 3480 (2023). https://doi.org/10.1038/s41467-023-39233-7
运营/排版:何晨龙
好了,关于解锁蛋白质科学新领域:北大团队提出拓扑改造新方法,助力迈向高分子化学“圣杯”就讲到这。
版权及免责声明:凡本网所属版权作品,转载时须获得授权并注明来源“科技金融网”,违者本网将保留追究其相关法律责任的权力。凡转载文章,不代表本网观点和立场,如有侵权,请联系我们删除。
相关文章
- “小行星”我国2030年前后 实现载人登月
- “都是”A股的觉醒之年!
- “孩子”一生的功课
- “益康”倍益康上市几个月收入净利都大减 市值仅几亿 创始人张文有啥办法?
- “科幻”嘉宾共话科幻的未来:被视为“珍贵市场”,中国科幻正青春
- “灯会”红星观察|自贡灯会走出“春节舒适区”:首次试水中秋国庆主题灯会火出圈背后
- “华为”新麒麟全面替代!曝华为正在清理骁龙机型库存:掀起全线新品的“洪流”
- “鸟类”评论丨大楼玻璃贴膜防鸟撞,城市的天空如何助鸟自由飞翔?
- “同济大学”四川“无臂青年”彭超参与杭州亚残运会火炬传递,曾用脚写字考上同济大学研究生
- “模型”人工智能公司OpenCSG发布大模型开源生态社区“传神”
- “结构”结核杆菌致病机制获揭示
- “口信”支持外贸稳规模优结构,金融监管总局发文加强出口信保公司地市级分支结构管理
- “分子”《科学》(20231013出版)一周论文导读
- “结构性”终于松口了!
- “核糖核酸”我国科学家揭示外源核酸诱导的原核生物短Ago蛋白系统发挥功能的分子机理
- “蛋白质”利用进化扩散进行蛋白生成,微软开源新型蛋白质生成AI框架EvoDiff
- “核糖核酸”原核短Ago系统在病毒入侵前后有啥变化?研究揭示
- “蛋白质”浙大团队用深度学习方法进行高效、准确的大型文库配体对接,助力药物开发
- “氨基酸”南京大学研究团队实现纳米孔蛋白质组学重大突破
- “数学”华中科大学者郇真申请项目已获国家自然科学基金资助









