“细胞膜”《自然》双重磅:改写教科书!科学家首次看清细胞程序性死亡过程,竟是细胞自主将细胞膜切块导致细胞裂解
今天,很高兴为大家分享来自199IT的《自然》双重磅:改写教科书!科学家首次看清细胞程序性死亡过程,竟是细胞自主将细胞膜切块导致细胞裂解,如果您对《自然》双重磅:改写教科书!科学家首次看清细胞程序性死亡过程,竟是细胞自主将细胞膜切块导致细胞裂解感兴趣,请往下看。
近日,由瑞士巴塞尔大学Sebastian Hiller、洛桑大学Petr Broz和德国斯图加特大学Kristyna Pluhackova领衔的研究团队[1],以及由美国基因泰克公司Vishva M. Dixit和Nobuhiko Kayagaki领衔的研究团队[2],在顶级期刊《自然》上发表的两篇研究论文,让我心潮澎湃。
简单来说,Hiller团队借助于高分辨率的成像技术,解析了膜蛋白NINJ1调节细胞破裂的全过程:当细胞发出程序性死亡的信号之后,NINJ1被激活并在细胞膜表面聚集,形成类似“拉链”的聚合物,像拉开拉链一样打开细胞膜,导致细胞裂解[1]。而Dixit团队则发现,用单抗阻断NINJ1的聚集,可以抑制细胞膜的破裂,保护组织免受损伤[2]。
这两个研究再次证实,细胞程序性死亡导致的细胞破裂,不是被渗透压的变化胀破的,而是细胞用NINJ1自主切割细胞膜,导致细胞解体。毫无疑问,这一发现有重大价值。因为癌细胞对死亡有抗性,而神经退行性疾病等又是细胞死亡导致的,因此这一发现有望给这些疾病的治疗带来革命性的变化。
在我看来,这两篇论文是理解细胞死亡的新里程碑,让我们对细胞的程序性死亡有了颠覆性的认知,我们的教科书也会因此改写。
 Hiller团队论文首页截图
Hiller团队论文首页截图事情还得从2021年开始说起。
那一年的1月20日,Dixit和Kayagaki领衔的团队在《自然》发表了一项重要研究成果[3]。
他们为了找到细胞膜破裂的机制,开展了大规模的遗传学筛选,最后找到了一个大小为16kDa的双重跨膜蛋白NINJ1。他们发现,只要敲除编码NINJ1的基因,巨噬细胞响应焦亡、坏死和凋亡的细胞破裂就会受损,即使细胞已经死了,但是就是不破。也就是说,细胞死亡时细胞膜的裂解是受细胞控制的一个自主过程。

正常情况下,双重跨膜的NINJ1蛋白
他们这项开创新研究成果颠覆了“细胞死亡相关的细胞膜裂解是被动过程”这一普遍认知。不过,当时他们并不知道NINJ1是如何调节细胞膜裂解的,对NINJ1介导的细胞膜裂解的生理功能也缺乏认知。今天我们要介绍的这两个研究,就分别解决了上述两个问题。
咱们先来看看Hiller、Broz和Pluhackova团队的研究成果。
借助于超分辨率显微镜,Hiller和他的同事们发现,对于已经下达程序性死亡信号的细胞而言,NINJ1会被激活并结合在一起,将原本摆在细胞膜外的两个α螺旋(α1和α2)插入细胞膜内,随后周边的NINJ1会结合上来,形成更大的聚集体。

NINJ1的聚集
在大约10%的细胞中,Hiller团队观察到长达几微米的NINJ1细丝(有单丝,也有双丝,双丝打开是环状),它们连接着较大的NINJ1聚集体。
 超分辨率显微镜下看到的NINJ1聚集体(左图:NINJ1丝,右图:双丝打开后成的环)
超分辨率显微镜下看到的NINJ1聚集体(左图:NINJ1丝,右图:双丝打开后成的环)至于NINJ1聚集体成究竟是如何打开细胞膜的,Hiller团队从NINJ1聚集体的极性解开了谜团。
他们发现,NINJ1聚集体的两个面极性不同,一面是亲水的(α1和α2螺旋这面),一面是疏水的(α3和α4螺旋那边),这恰好是典型成孔蛋白的特性。

NINJ1聚集体极性的分析
在体外的研究中,Hiller团队将45个完整的NINJ1连在一起,组成一个圆环,发现它们能持久地维持成一个小孔。
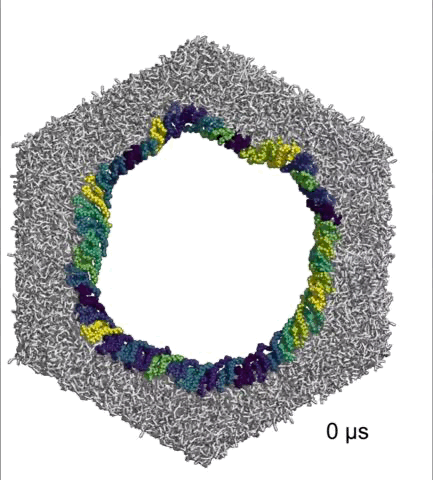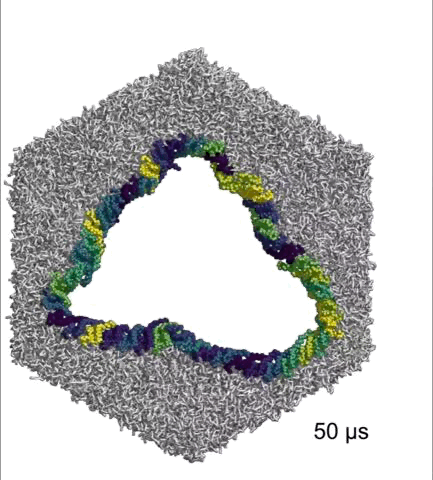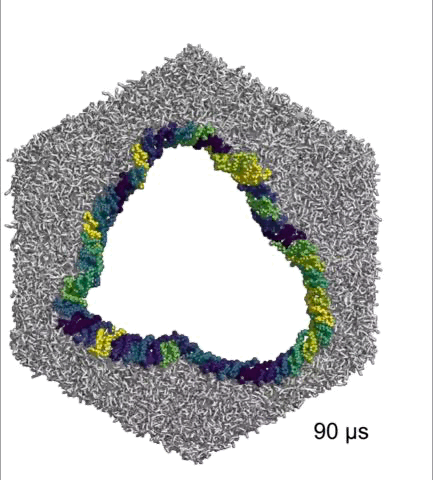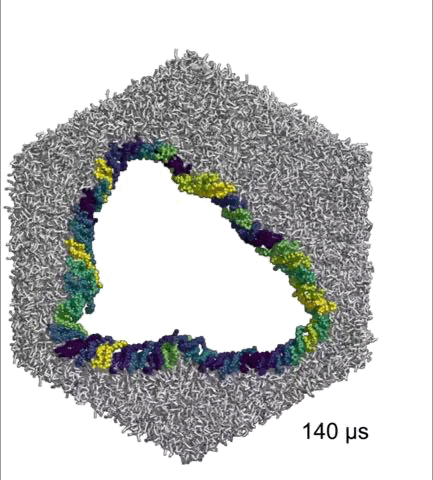
完整NINJ1组成的环可以持续打开
而一旦删除NINJ1的α1和α2螺旋,在短短的几十微秒之内,原本打开的圆环就完全关闭了。

失去α1和α2螺旋后,NINJ1环迅速闭合
基于以上研究数据,Hiller团队认为,α1螺旋既能稳定NINJ1丝,又能赋予其可塑性,在细胞膜成孔的过程中发挥着至关重要的作用。而且,NINJ1单丝和NINJ1双丝(环)都可以破坏细胞膜,双丝打开细胞膜的方式与拉链类似。
在Dixit等人的研究中,他们开发了一个名为D1的强效抗NINJ1抗体。研究发现,D1能抑制NINJ1聚集成丝,抑制细胞在焦亡和凋亡的情况下破裂,保护相应的组织免受损伤。
 机制示意图
机制示意图总的来说,这两个研究再次证实,细胞程序死亡相关的细胞膜裂解不是一个被动的过程,而是受细胞自身调控的自主过程。细胞在下达死亡命令之后,NINJ1被激活聚集成丝,导致细胞膜表面形成长达数百纳米到几微米的缺口,最终导致细胞膜裂解。
用Hiller团队论文一作Morris Degen的话来说:“这种方式将细胞膜一块一块地劈开,直到细胞完全瓦解”[4]。
至于这一系列研究的意义,在文章的开头,我已经提到过。癌细胞对死亡的抗性是否与NINJ1有关?如果有,是否可以以NINJ1为突破口,找到杀死癌细胞的新方法?此外,神经退行性疾病、心血管疾病等很多疾病,因细胞死亡而起,因此,围绕NINJ1或能找到阻止细胞死亡,防止组织损伤的新疗法。
总之,这三个研究打开了一扇新大门,或许会给很多疾病带来新的治疗方向。
一切才刚刚开始,让我们拭目以待。
参考文献:
[1].Degen M, Santos JC, Pluhackova K, et al. Structural basis of NINJ1-mediated plasma membrane rupture in cell death. Nature. 2023;10.1038/s41586-023-05991-z. doi:10.1038/s41586-023-05991-z
[2].Kayagaki N, Stowe IB, Alegre K, et al. Inhibiting membrane rupture with NINJ1 antibodies limits tissue injury. Nature. 2023;10.1038/s41586-023-06191-5. doi:10.1038/s41586-023-06191-5
[3].Kayagaki N, Kornfeld OS, Lee BL, et al. NINJ1 mediates plasma membrane rupture during lytic cell death. Nature. 2021;591(7848):131-136. doi:10.1038/s41586-021-03218-7
[4].https://www.unibas.ch/en/News-Events/News/Uni-Research/Under-control-to-the-very-end—how-our-cells-kill-themselves.html
来自:奇点网
好了,关于《自然》双重磅:改写教科书!科学家首次看清细胞程序性死亡过程,竟是细胞自主将细胞膜切块导致细胞裂解就讲到这。
版权及免责声明:凡本网所属版权作品,转载时须获得授权并注明来源“科技金融网”,违者本网将保留追究其相关法律责任的权力。凡转载文章,不代表本网观点和立场,如有侵权,请联系我们删除。
相关文章
- “在我”忆来只把旧书读
- “科博会”芜湖科博会集中展示大国重器
- “诗人”带着大海散步的人
- “宁德”宁德时代三季报:业绩增速放缓、海外市场份额扩大
- “新材料”信金控股完成新一期人民币基金首关
- “同比增长”失守3000点后,A股市场的危与机|智氪
- “商务部”商务部:达成共识!
- “基金”又一家基金公司换董事长,年内公募高管变动人数增至321人
- “模型”解决大模型复现难、协作难, 这支95后学生团队打造了一个国产AI开源社区
- “教师”北京化工大学回应学院院长被指骚扰教师:已成立工作专班,对师德失范问题零容忍
- “肌肉”磁铁刺激疗法可“对齐”肌肉纤维
- “微生物”他们的研究与所有人的健康相关,你却容易忽略!
- “细胞”免疫疗法产业“井喷”:精准医疗基于临床需求
- “细胞”器官移植或不再需要长期免疫抑制
- “衰老”中国科学家揭示人类基因组中的“年轻化”基因
- “细胞”新研究表明一种经过改进的CAR-T细胞有望治疗卵巢癌等实体瘤
- “细胞系”巴西将成全球干细胞库实验场
- “免疫”中国科学院团队合成新型纳米颗粒,成功降低免疫抑制细胞含量,实现高效的原位抗肿瘤免疫激活
- “多倍体”山大团队发表人工多倍体大肠杆菌创建新进展
- “样本”存放几十年老样本重见天日:科学家研发单细胞DNA测序法,可用于研究存档的癌症样本









